不凍タンパク質
寒冷圏に生息する魚や昆虫は氷結晶の成長やそのかたちを制御する特殊なタンパク質を持っており、それが体液の凍結を防ぐ効果を示すので厳しい冬を生き抜くことができると言われています。この特殊なタンパク質は、不凍タンパク質(Anti-Freeze Protein、AFP)と呼ばれます。AFPの構造や性質は、生物の種類によって異なります。たとえば寒冷地に住む魚のカレイに含まれるAFPはα-ヘリックスと呼ばれるシンプルなコイル状の構造を持っており(図1)、この分野の研究でよく取り上げられます。AFPは他のタンパク質と何が違うのでしょうか?水が凍結する温度(凝固点)は0℃です。通常、タンパク質や不純物分子、イオンなどが水に混入していても微量であれば凝固点はほぼ0℃のまま変わりません。しかし、AFPが混入している場合はたとえ微量でも凝固点が劇的に下がります。ここで注意すべきことは、氷が融ける温度(融点)は0℃のまま殆ど変らないということです。すなわち、通常は同じはずの融点と凝固点に顕著な差ができること(サーマル・ヒステリシスと呼ばれます)、これがAFPの特殊な性質なのです。厳密には、0℃以下で“凍結しない”というのは言い過ぎのようです。実際には、水の中で小さな氷結晶が沢山できているようです。それでもAFPが“不凍”タンパク質と呼ばれるのは何故なのでしょうか。
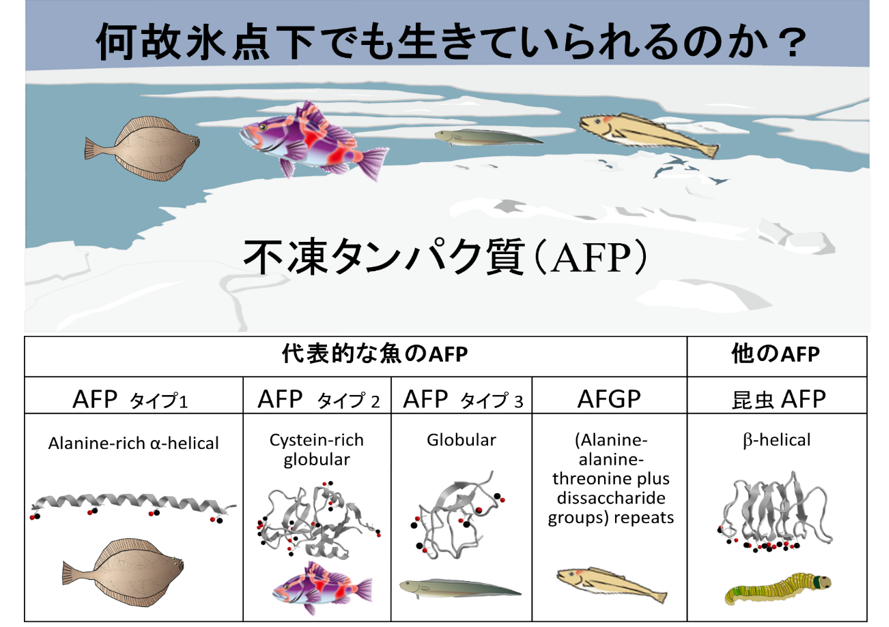
図1 代表的な魚と昆虫のAFP
通常は水の中でひとたび氷の結晶核生成が起きると、その核がそのまま成長していき、やがて水全体が氷になります。しかし、AFPが水に混入していると氷の結晶が成長するにつれて“あるかたち”に変化し、すると成長がまるでストップしてしまったかのようにものすごく遅くなります。このため、なかなか水全体が氷になりません。また、通常は水の中で小さな氷結晶がたくさんできた場合、結晶同士がくっつくと、やがて結晶間の境界が消失して一つの結晶へと変わり(再結晶といいます)、それを繰り返すことにより小さな氷結晶の集まりは一つの大きな氷の結晶へと変わっていきます。通常この再結晶は不純物が混入していても起きます。しかし、AFPが混入しているとその再結晶は起きません。これらがよく知られているAFPの特徴であり、冬場にAFPをつくりだす生きものが凍結死しないことと何らかの関連があるのかも知れません。これらAFPの性質はどこから生まれるのか?それを理解するポイントは、AFPがつくる氷結晶の“かたち”にあります。
純粋な過冷却水から成長する氷結晶は、薄い円盤もしくは氷結晶構造の六方対称性を反映した薄い樹枝状のかたちを持ちます。これらかたちの特徴は、通常は不純物が混入している場合でも同じです。しかし、AFPが混入している場合は、そのかたちは全く異なるものに変わります(図2)。
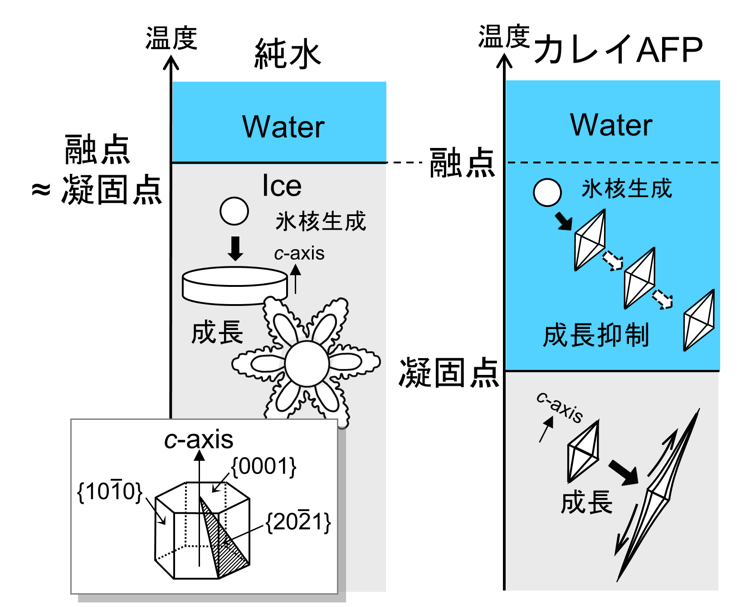
図2 カレイAFP存在下で起こるサーマル・ヒステリシス。 AFPが溶け込んだ水を融点以下まで冷却すると核生成した氷結晶がピラミッド形状となって、そこで成長が止まってしまったかのようになる。ある温度(凝固点)以下になると、ピラミッド形状の先端が伸びていく成長が起こり、やがて過冷却水全体が凍結する。しかし、その場合も氷の融点は殆ど変っていない。
たとえば魚カレイのAFPの場合、二つの六角錘が上下反対に底面でつながったようなかたちになります。このかたちに現れる六角錘の側面にあたる結晶面(以下、ピラミッド面と呼ぶことにします)は、純水や他の不純物が混入した過冷却水から成長する氷の結晶形には平らな広い面として出現しません。このピラミッド面の出現は、そこでの成長が他の面方位に比べてすごく遅いことを意味します。したがって、ひとたびこのかたちになると、氷結晶全体が成長のすごく遅いピラミッド面で覆われてしまっているため、まるで成長がストップしたかのようになるわけです。
何故ピラミッド面が現れるのか?それは、AFPがピラミッド面に吸着してそこでの成長を抑制するためだと想像するのが自然です。しかし、それが本当かどうか?また、もし本当だとしたら、何故どのように吸着し、そしてどのように氷の成長を抑制するのか?それらを実験的手法により明らかにするのは極めて困難です。コンピュータ・シミュレーションが大変強力な研究手段です。
研究の概要
私たちは、カレイのAFPが吸着した氷ピラミッド界面での結晶成長機構を分子動力学(Molecular Dynamics, MD)法とよばれるコンピュータ・シミュレーションにより調べました。私たちのシミュレーションは、氷ピラミッド面に吸着したAFPの周辺において氷の成長速度の急激な減少を示しました。この成長速度の激減は現実のAFPによる氷の成長抑制に対応したものと考えています。成長速度の激減は、AFPが界面に安定に配置したときにしか起こりませんでした。AFPには、水に馴染まない(疎水性といいます)原子が並んだ部分と水に馴染む(親水性といいます)原子が並んだ部分があります。AFPは、疎水性の部分が氷側に向いて親水性の部分が水に向いた状態で界面に安定吸着することがわかりました(図3)。また、周辺に氷が成長することによりAFPがその成長氷に少し“埋もれる”ことも吸着が安定になる要因の一つであることがわかりました。
図3 AFPが吸着した氷ピラミッド面―過冷却水界面の分子動力学シミュレーション。約4ナノ秒(1ナノ秒=10億分の1メートル)経過後、AFP周辺に氷が成長したが、疎水性メチル基が氷に向いた状態でAFPは安定吸着したままとなり、そして周辺の氷の成長速度が激減した。(J. Phys. Chem. 112 (2008) 7111; Polymer J. 44 (2012) 690; 化学と工業 69 (2016) 642 他)
成長速度激減の原因の一つとして、AFPの周辺に成長した氷の先端が凸に丸みを帯びたことによるギブス・トムソン効果(またはケルビン効果)が考えられます(図4)。ギブス・トムソン効果とは、界面の曲率に比例して局所的な氷の融点が0℃より低くなる現象です。
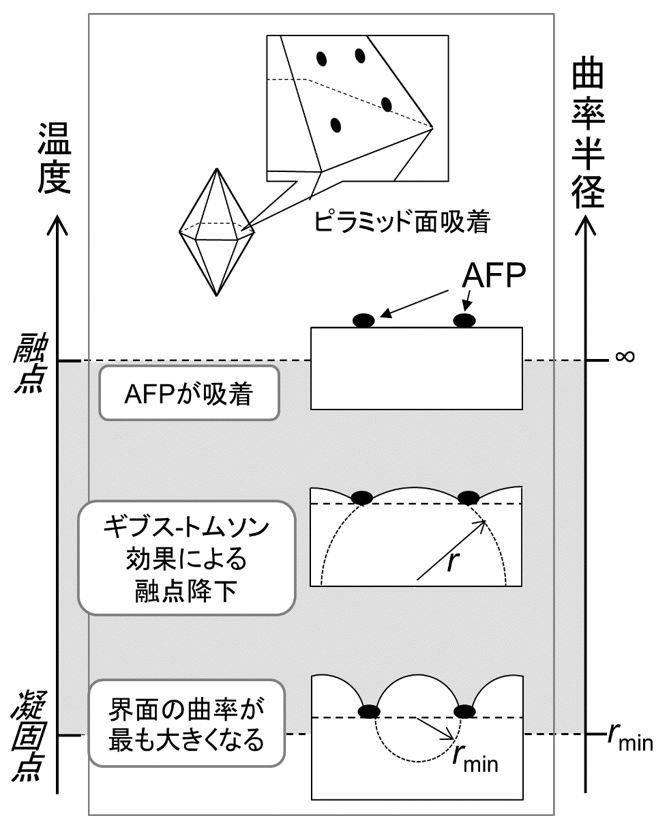
図4 ギブス・トムソン効果による氷の成長抑制。吸着AFP周辺に成長する氷の先端界面は丸みを帯びる。丸みを帯びた界面での融点は曲率に比例して下がるため、成長が徐々に遅くなり、最終的に成長がストップする。
私たちは、シミュレーションにおいて激減した成長の速度とギブス・トムソン効果から予測される成長の速度とを比較してみました。その結果、成長速度の激減はギブス・トムソン効果で大雑把に説明できることがわかりました。しかし、まだ不確かな部分もあり、現実のAFPによる氷の成長制御が果たしてギブス・トムソン効果だけで説明できるのかどうかは、今後の大規模なシミュレーションも交えて検討を重ねる必要がありそうです。また私たちは、魚カレイのAFPだけでなく、不凍効果が極めて高いことで知られている昆虫のAFPのシミュレーション研究も行っています。これまでに、極めて高い不凍効果と関係していると思われるAFP界面吸着特性などを明らかにしています。本研究は、北海道大学低温科学研究所古川義純教授(現:名誉教授)と共同で実施しました。
氷核タンパク質
水の温度を少しずつ下げていき氷の核生成が起こる温度を測定する実験を行うと、純水の場合は通常-35℃以下の低い温度にならないと氷の核生成が起きません。しかし、水の中に何か異物が入っていると、その異物を足場として核生成が起こることがあり、その場合もっと高い温度で氷の核生成が起きます。その中でも、特に核生成温度を著しく上げる物質は氷核活性物質と呼ばれることがあります。人工降雪剤としても使われてきたヨウ化銀は、代表的な氷核活性物質です。氷核タンパク質(Ice-Nucleation Protein、INP)も、ヨウ化銀と同様に氷の核生成温度を著しく上げる氷核活性物質です。
INPは、シュードモナス属やキサントモナス属のバクテリアなどが持つことで知られています(図5)。INPを持つバクテリアは氷核活性細菌と呼ばれることもあります。バクテリアは冬になると植物の葉に着生してINPの作用により葉を凍結させて亀裂を生じさせ、その中に入り込んで増殖のための栄養をとっていると考えられていますが、バクテリア生命活動へのINPの役割は未だよくわかっていません。
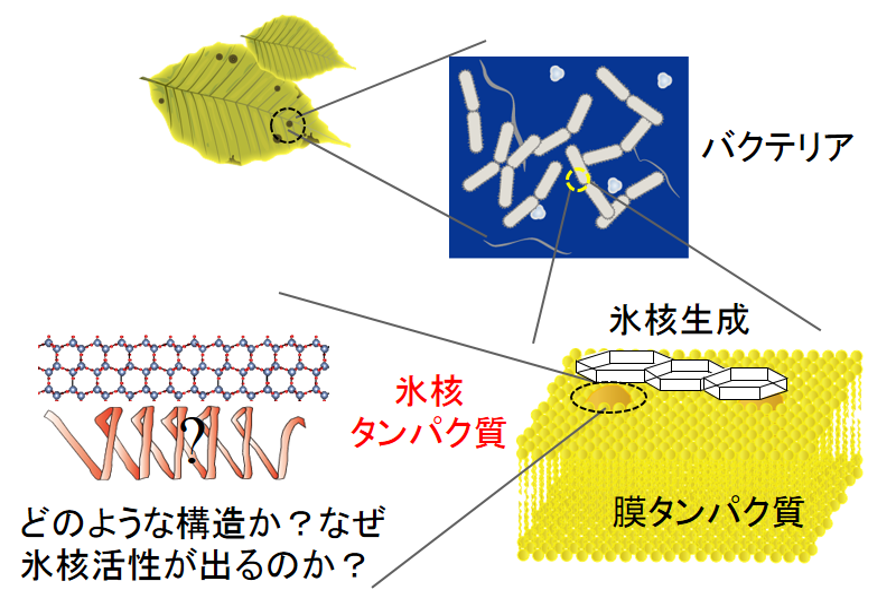
図5 バクテリア表面の脂質膜に存在すると思われているINP。しかし、その構造はまだ判っていない。
INPのような氷核活性物質は、人工降雪剤の開発や氷製造技術の開発などと関係して実用的にとても重要です。とりわけバクテリアのINPは、あらゆる氷核活性物質のなかでも特に氷核活性が高いことで知られており、基礎科学の研究対象としてとても魅力的です。しかし、そのINPがなぜ氷の核生成を促進するのかは、まだよくわかっていません。その最大の原因は、INPの構造がよく判らないことにあります。INPはその大部分がバクテリア表面の脂質膜にめり込んだ状態になっており(そのようなタンパク質は膜タンパク質と呼ばれます)、氷核効果を持つ部分は脂質膜から顔を出していると考えられています。そのような状態でINPの氷核効果を持つ部分はどのような構造をとっているのか、その詳細な決定はかなり難しいのが現状です。
研究の概要
私たちは、INPを持つバクテリア水溶液からの氷の結晶成長実験からINP構造の特徴を探る研究を行っています。バクテリアINPは氷の核生成を手助けするテンプレートとして働くと考えられており、もしそうならばINPの構造は部分的には氷のある結晶面構造と類似していると考えられます。したがって、INPもAFPのように特定の氷結晶面に吸着する性質があるのではと考えられます。その吸着面が判れば、INPの構造の特徴を考察することができます。
本研究では、氷核活性細菌(Xanthomonas Campestris)を混入した過冷却水から成長する氷結晶を実験観察し、その成長形の特徴からINPが氷結晶のどの面に吸着するかを推測しました(図6)。実験の結果、純水から成長の場合とよく似た薄い円盤もしくは薄い樹枝状の成長形となることがわかりました。しかし、成長する氷結晶は氷核活性細菌の濃度が上昇するにつれてどんどん薄くなることがわかりました。
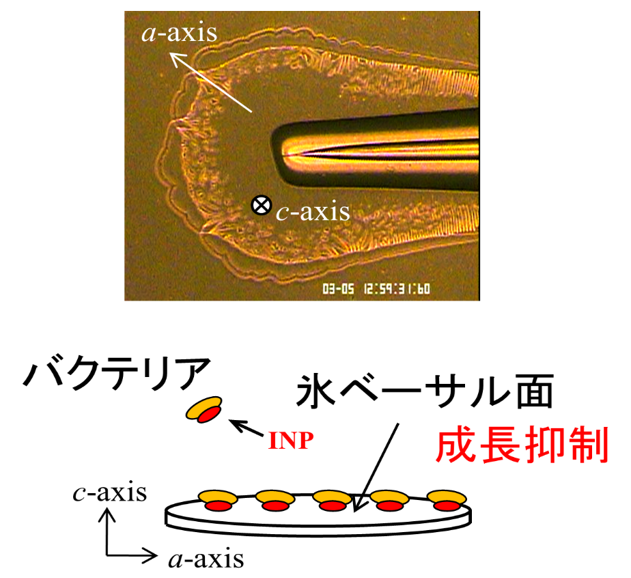
図6 氷核活性細菌を含む過冷却水から成長する氷結晶。細菌濃度は1 mg/ml。氷の成長形の特徴は純水の場合と同じであるが、純水のときに比べて c 軸方向が薄くなることがわかった。INPが氷結晶のベーサル面に選択的に吸着し、そこでの成長を抑制した可能性がある。(Chem. Phys. Lett. 498 (2010) 101)
INPが吸着する面では成長が遅くなると考えるのが自然です。本研究の実験結果より、INPは氷の{0001}ベーサル面とフィットするような構造を持つと予測されます。今後、より発達した実験技術によるINP構造解析に加え、コンピュータ・シミュレーションなどによるINP構造と氷結晶面とのマッチングの研究などを行い、本研究の予測を検証していくことが重要です。本研究は、北海道大学低温科学研究所古川義純教授(現:名誉教授)と共同で実施しました。
3. 炭酸カルシウム(生きもののつくる鉱物)
炭酸カルシウムは地球上に豊富に存在する鉱物です。炭酸カルシウムには、何種類かの異なる結晶構造(結晶多形といいます)が存在します。室温・大気圧で最も安定な結晶はカルサイトです。アラゴナイト、バテライトといった炭酸カルシウム結晶もよく知られています(図7)。

図7 代表的な炭酸カルシウム結晶。緑、赤、灰色の球は、それぞれおカルシウムイオン、酸素原子、炭素原子を示している。大気圧・室温で最も安定な結晶はカルサイト。しかし、生成条件によってはアラゴナイトやバテライトといった安定性がやや低い(準安定といいます)結晶が形成されることもある。正確なバテライトの結晶構造はよくわかっていない。最近、バテライト構造が複数存在している可能性も指摘されている(図はMeyerら(1959)が提案するバテライト構造を代表して示している)。
炭酸カルシウムは生きものの体の中でも作られます。たとえば、私たち人間の耳の奥にはカルサイトの小さな結晶がつくられており、それらは重力センサーとして働いているといわれています。生きものによってはカルサイト以外の結晶がつくられることもあります。たとえば、貝殻の中ではアラゴナイトもつくられます。私たちの骨や歯をつくるリン酸塩結晶なども含め、生きものによる鉱物結晶づくりはバイオミネラリゼーションとよばれます。
バイオミネラリゼーションによってつくられる結晶は、構造も機能もとても優れています。貝殻はとても強度の高いものであり、真珠は美しく、骨はひびが入っても自分で修復できます。もちろん、私たちも同じ構造や機能をもつ結晶を人工的につくることができるかもしれません。しかし、そこでは複雑な生産工程により大量のエネルギーを費やすに違いありません。生きものは電気エネルギーなど全く必要とすることなく、自然に身についている技術で結晶づくりをいとも簡単にやり遂げます。この生きもののもつ技術、それこそ真に“環境に優しい”技術と呼べるものなのではないでしょうか。バイオミネラリゼーションには、私たちが目指すべき結晶づくり技術のエッセンスが凝集しているのです。そのなかでも炭酸カルシウムは最も基本的な結晶なため、その核生成や結晶成長のしくみをよく理解し、生きものがそれらを如何にして制御しているかを探ることが、私たちにとって極めて重要な課題です。
研究の概要
- バイオミネラリゼーションにおいては、結晶核生成、結晶成長、結晶のかたち、そして結晶多形が有機分子など添加物の影響を強く受けています。私たちは、カルサイトの結晶成長が有機分子により制御されるメカニズムを明らかにするためのコンピュータ・シミュレーション研究を行っています。本研究では、有機分子としてアスパラギン酸を使った研究を行っています(注)。成長するカルサイト結晶にアスパラギン酸を添加すると、{104}面に現れる炭酸カルシウムイオン層の段差(ステップといいます)のうち、[11
4 )]方向の鋭角ステップ先端だけに凸凹模様が現れること(ラフニングといいます)が知られています。この現象はそこのステップ先端のみにアスパラギン酸が吸着することを反映したものと想像できますが、それを実証するためにはコンピュータ・シミュレーションによる分子レベルの解析が必要です。
私たちは、カルサイト{104}面上におけるアスパラギン酸挙動を分子動力学法と呼ばれるコンピュータ・シミュレーション法により詳しく解析しました(図8)。シミュレーションは、凸凹模様が現れる[114 ]方向鋭角ステップ先端部分にアスパラギン酸が選択的に吸着することを示しました。そこへの選択的吸着は、アスパラギン酸と結晶表面イオンとの相互作用だけではなく、周辺の水との相互作用が極めて重要な役割を果たしていることがわかりました。また、平坦{104}面上においてアスパラギン酸が水分子一層分を隔てて吸着する傾向があることや、ステップ先端の折れ曲がり角部分(キンクといいます)ではより安定に吸着しやすいことなどもわかってきました。特に、周辺の水が吸着に及ぼす影響に関しては、今後様々な分子に対して幅広く研究を行い、より理解を深めていくことが重要と考えています。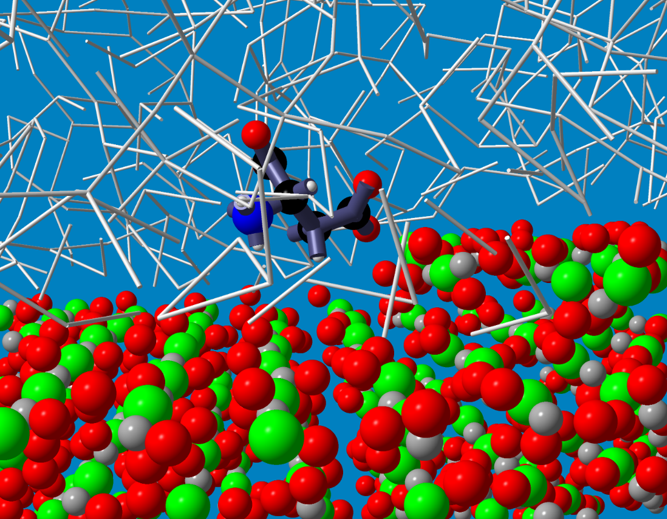
図8 分子動力学シミュレーションが予測するカルサイト{104}面上の[114]鋭角ステップエッジへのアスパラギン酸吸着構造。灰色の太線は水分子間の水素結合を表している(水分子は表示していない)。(J. Phys. Chem. C 118 (2014) 14335; Polymer J. 47 (2015) 84 他)
(注)生きものの中ではアスパラギン酸が沢山連なったポリアスパラギン酸がバイオミネラリゼーションにおける制御分子として働いていると言われています。
- バイオミネラリゼーションにおいては、炭酸カルシウムの結晶多形がマグネシウムイオンによる影響を強く受けることがあります。たとえば、貝殻を形成する炭酸カルシウムの結晶多形はマグネシウムイオンにより制御されていると言われています。また、マグネシウムイオンは炭酸カルシウムの結晶核生成を抑制することでも知られています。しかしながら、何故どのようにマグネシウムイオンが結晶多形や結晶核生成を制御するのかには未だよくわからない部分が多く残されています。
最近の研究により、炭酸カルシウムの結晶核生成が起こる前に水溶液中のイオンが集まった小さな塊(ここでは前駆体と表現します)が形成されることがわかってきました。その前駆体の構造は、イオン配列が乱れたまま固まった構造(アモルファス構造といいます)に近いと考えられます。バイオミネラリゼーションにおいても、まず炭酸カルシウムのアモルファスが形成されてそこから結晶核生成が起こることがあります。前駆体の構造を詳しく調べることにより、結晶多形や結晶核生成が何故どのように不純物マグネシウムの影響を受けるのかが判るかもしれません。
私たちは、炭酸カルシウム結晶核生成の前駆体がアモルファス構造を持つと仮定し、アモルファス構造のマグネシウム添加による影響を分子動力学法と呼ばれるコンピュータ・シミュレーション法により調べ、現実の結晶多形や結晶核生成のマグネシウム添加依存性との関係を考察しました(図9)。シミュレーションの結果、純粋なアモルファスには長距離的な構造秩序は存在しないものの、局所的な構造は、結晶、とくにバテライトに類似していることがわかりました。しかし、マグネシウムを添加するとそのバテライトに類似した局所構造が形成されなくなり、構造全体がより無秩序になることがわかりました。本シミュレーション結果により、前駆体の構造がある結晶の構造に近ければ近いほどその結晶が核生成しやすくなると仮定すると、純粋な炭酸カルシウムからはバテライトが核生成しやすいことやマグネシウム存在下では結晶核生成が起こりにくくなることなどの実験事実がある程度説明できます。今後、より詳しい研究を行っていくことが重要です。本研究は、東京大学大学院工学系研究科化学生命工学専攻・加藤隆史教授の研究グループと共同で実施しました。 - 炭酸カルシウムの結晶成長にはまだわからないことが沢山あります。私たちは、炭酸カルシウム結晶-アモルファス界面での成長メカニズムを分子動力学法と呼ばれるコンピュータ・シミュレーション法により調べました。その結果、アモルファスのイオン配列が界面において“集団的に“結晶配列に変わっていく様子を捉えることに成功しました。また、本研究において、アラゴナイト結晶とバテライト結晶の(001)面上においてカルサイト結晶が不均一核生成して成長することがあることがわかりました。本研究のシミュレーションは1500 Kという極めて高温で行われたため、これらの研究結果が現実の炭酸カルシウム結晶成長とどれだけ関係しているか、今後さらなる研究を行い検討していく必要があります。本研究は、東京大学大学院工学系研究科化学生命工学専攻の加藤隆史教授の研究グループと共同で実施しました。
- 炭酸カルシウムと同様に、二酸化チタンの結晶成長や結晶のかたちも有機分子など添加物の影響を強く受けます。二酸化チタンとは、白色顔料や光触媒材料、骨や歯の治療のための生体活性物質などに利用される物質です。二酸化チタンのルチル型結晶のかたちは、グリコール酸、乳酸、ヒドロキシ酪酸などのヒドロキシ酸の添加により制御されることが実験的に知られています。私たちは、そのメカニズムを分子動力学シミュレーション法などにより調べています。これまでに、ルチル型結晶へのヒドロキシ酸イオンの吸着頻度や吸着構造が結晶面方位によって異なることなど、結晶のかたちの制御と関係するシミュレーション結果を得ることに成功しています。本研究において、炭酸カルシウムの場合と同様に、ヒドロキシ酸イオンの吸着構造は周辺の水に強く支配されていることがわかりました。今後、結晶表面の水に注目した結晶成長や結晶のかたちの制御の研究が重要と思われます。本研究は、東北大学多元物質科学研究所の垣花眞人教授および小林亮助教(現:名古屋大学未来材料・システム研究所准教授)と共同で実施しました。
これらの研究は、文部科学省科学研究費補助金新学術領域研究「融合マテリアル:分子制御による材料創成と機能開拓」(平成22~26年度)の助成などを受けて実施されました。
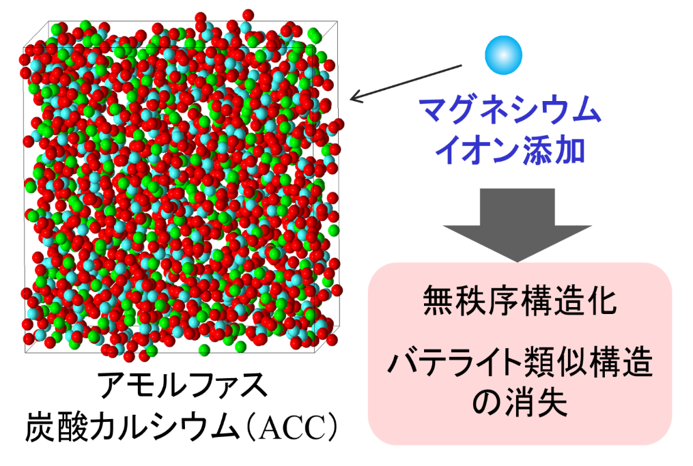
図9 アモルファス炭酸カルシウム構造のマグネシウム添加依存性の分子動力学シミュレーション解析。
※本ページにて紹介した研究成果は、産業技術総合研究所在職時のものです。