氷の結晶成長メカニズム
普段我々が目にする氷は、1hと呼ばれるウルツサイト型の六方晶構造を持ちます(図10)。雪の結晶が美しい六方対称性をもつ樹枝状のかたちなどになることはよく知られていますが、水の中から核生成して成長する氷の結晶も似たような薄い樹枝状のかたちになったり、あるいは薄い円盤のかたちになります。成長する氷の結晶があるかたちになるのは面方位によって成長の速さが異なるからです。氷の結晶が薄くなるのは、{0001}ベーサル面の成長(c軸方向の成長)がすごく遅く、それ以外のc軸に垂直な方向の成長が速いためです。何故、面方位によってそれほど成長速度が大きく異なるのでしょうか?その理由の一つとして、成長のメカニズムが面方位によって違う(異方性といいます)ことが挙げられます。成長メカニズムの異方性を明らかにすることは、氷結晶が成長してとるかたちを理解するために極めて重要なのです。そのためには分子レベルの解析手法が必要となります。コンピュータ・シミュレーションが強力な手法です。
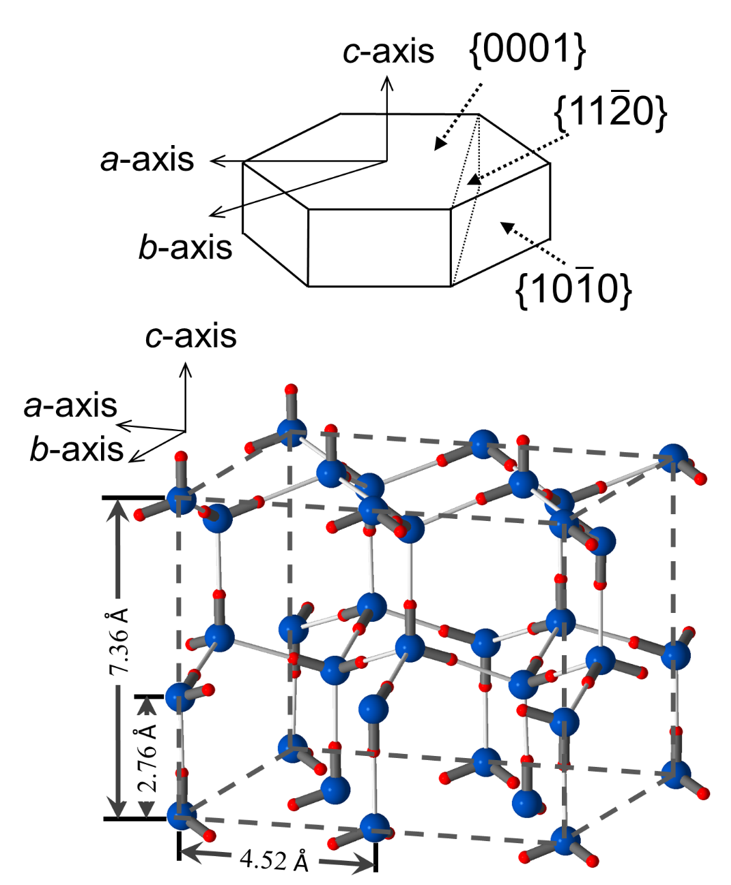
図10 氷1hの結晶構造。酸素原子と水素原子をそれぞれ大青球と小赤球で示している。
研究の概要
私たちは、分子動力学法によるコンピュータ・シミュレーションにより氷と水の界面における成長メカニズムの異方性を調べました(図11)。{0001}ベーサル面、{10
氷結晶中の各水分子は隣接する水分子4つと水素結合で安定に結ばれています。水の中の水分子も周辺水分子(3~4つの場合が多い)と水素結合で結ばれ、時に切れたりまた結ばれたり、となりの水分子が別な水分子と入れ替わってそれと結ばれたり切れたりを繰り返しています。氷の成長は、この激しく動いている液体の水の水素結合のネットワーク構造が徐々に氷結晶の規則正しい構造へ変わることにより起こります。シミュレーション解析の結果、その水素結合ネットワークの氷結晶構造化はプリズム面や二次プリズム面上では三次元的に起こるのに対し、ベーサル面上ではどちらかというと二次元的に起こることがわかりました。この違いは、氷―水の界面構造の違いを反映したものと考えられます。すなわち、プリズム面や二次プリズム面の界面では所々で氷結晶構造の先端部分が水側に突出したりまたそれが消失したりを繰り返しており、分子レベルで幾何学的にでこぼこしていますが、ベーサル面の界面はどちらかというと分子レベルで平坦です。
本シミュレーション解析から明らかになった成長メカニズムの異方性は、現実の氷の成長形をよく説明します。私たちの研究は、氷の結晶形のでき方を直接観察する分子動力学シミュレーションなど、より大規模かつ現実に近いものへと発展しつつあります。

図11 氷プリズム面-水界面(270 K, 1 atm)の分子動力学シミュレーション。赤球と白球は、それぞれ水分子の酸素原子と水素原子を示す。紙面に垂直な方向がc軸方向である。(J. Chem. Phys. 145 (2016) 244706)
ハイドレートの結晶成長メカニズム
クラスレートハイドレート(以下、ハイドレートと略記します)とは、水分子が異分子を包接した構造を持つ水和物結晶です。ガスハイドレートは、その代表的存在です(図12)。ガスハイドレートの結晶構造を部分的に見ると、水分子が“かご”をつくるように並んでその中にガス分子が閉じ込められているように見えます。ガスハイドレートは低温・高圧で形成され、地球上では海底や凍土中に存在しているといわれています。とくに、日本近海の海底に大量に存在しているとされるメタンハイドレートのメタンガスは、我が国の将来のエネルギー資源として期待されています。
ガス分子以外の物質分子のハイドレートとして、例えばテトラヒドロフラン(THF)と呼ばれる有機溶媒分子のハイドレートがあります。THFハイドレートは大気圧でも容易につくることができ、またその生成時にはTHF分子以外の分子も同時に取り込むこともできるため、THFハイドレート生成をエネルギー物質分子や環境負荷物質分子の回収技術へ応用することも検討されています。このような技術開発を行うためには、まず、何故どのようにガスハイドレートが形成されるのかという基本的メカニズムを理解することが重要です。
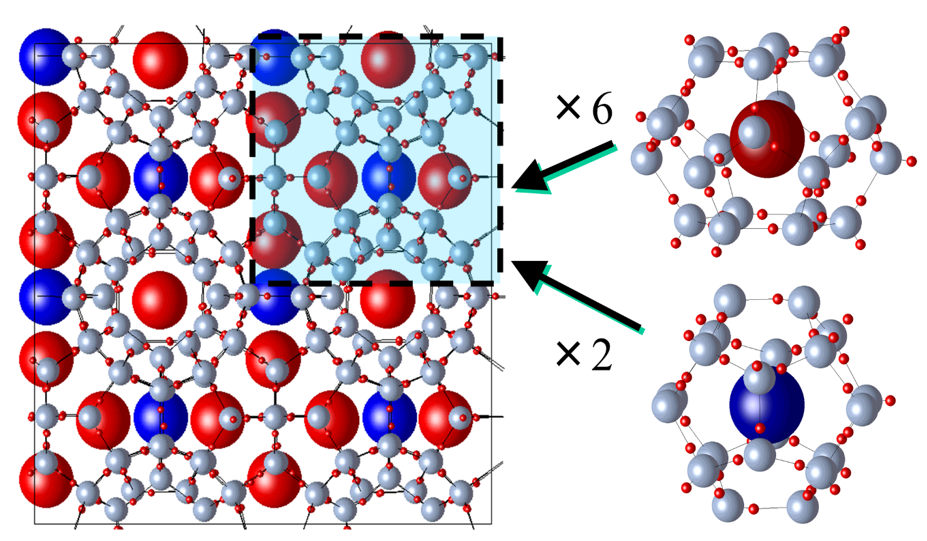
図12 メタンハイドレートなど代表的なガスハイドレートの結晶構造(1型と呼ばれる)。単位格子は46個の水分子(酸素原子:銀色球、水素原子:小赤球)からなり、そこにはガス分子が入り得る空間が合計8か所(やや広い空間6か所:大赤球、やや狭い空間2か所:大青球)。各空間に位置するガス分子の周辺水分子をピックアップしてみると、多面体からなる“かご”になっている。
研究の概要
私たちは、メタンハイドレートの結晶成長メカニズムを分子動力学法によるコンピュータ・シミュレーションにより調べました(図13)。シミュレーションでは、ハイドレートーメタン水溶液界面おいて、集まったメタンガス分子に囲まれた水分子たちがハイドレートのかご構造の一部に相当する多角形構造を形成していくプロセスが観察されましたが、個々のメタンガス分子を覆うように水分子たちが“かご”をつくってメタンガス分子をその中に閉じ込めるようなプロセスは観察されませんでした。ハイドレートの構造を見るとガス分子が水分子のつくる“かご”に閉じ込められているように見えますが、形成のプロセスにおいては、むしろガス分子に閉じ込められた水分子がハイドレート構造化をしているように見えます。私たちは、テトラヒドロフランハイドレートも同様なプロセスで形成されることを確認しています。今後、さらに詳しくメカニズムを調べていくことが重要です。
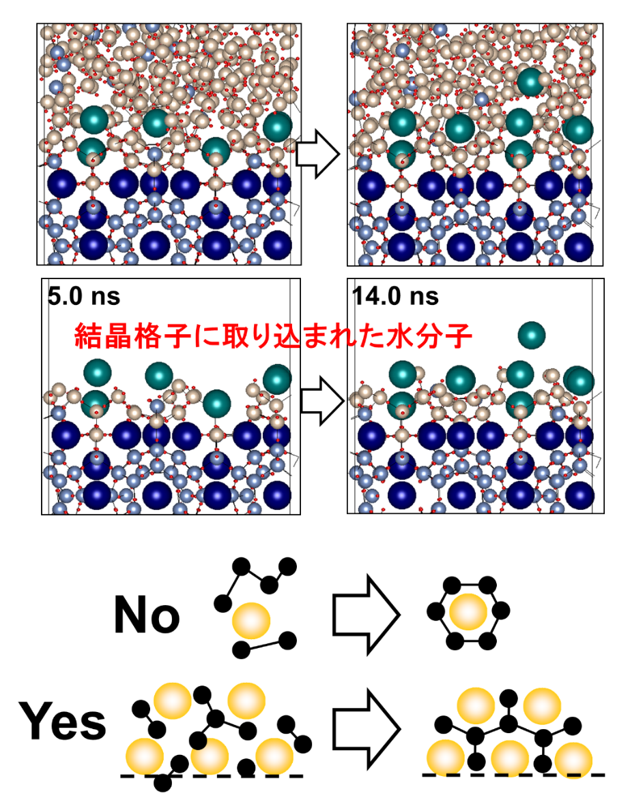
図13 分子動力学シミュレーションが予測するメタンハイドレート―メタン水溶液界面での成長メカニズム。大きい球(群青、深緑)はメタン分子、小さい球(薄青、金)は水分子の酸素原子を表す。ガス分子周辺の水分子が“かご”をつくるのではなく、ガス分子に囲まれた制限空間内の水分子が秩序構造化することによりハイドレートが成長していくようにみえる。(J. Phys. Chem. B110 (2006) 16526)
※本ページにて紹介した研究成果は、産業技術総合研究所在職時のものです。